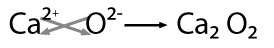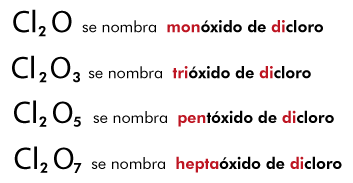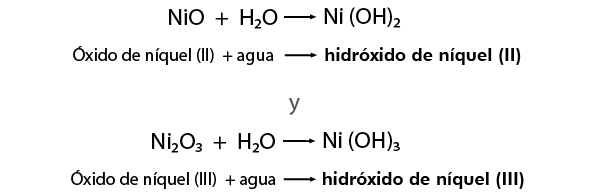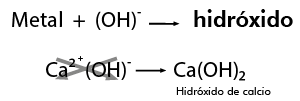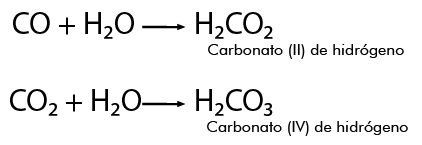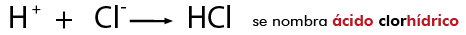REACCIONES DE OXÍGENO
El oxígeno es el elemento más abundante en el planeta Tierra, constituye aproximadamente el 50% en masa de la corteza terrestre y forma el 21% en volumen de la atmósfera; es componente activo del aire, se encuentra presente en el agua y como óxidos con otros elementos. Reacciona tanto con metales como con no metales y, entre los no metales es el segundo en reactividad química, después del flúor.
Todo fenómeno químico puede ser representado a través de una ecuación química , que nos muestra los cambios que se llevan a cabo, así podemos describir las variaciones que se realizan cuando se oxidan los elementos metálicos y no metálicos en presencia de oxígeno y con el auxilio de la energía calorífica.
REACCIONES DE ÓXIDO CON AGUA
Después de la formación de los óxidos correspondientes tanto metálicos como no metálicos, es factible combinarlos con agua para formar nuevos compuestos. En el caso de los óxidos metálicos cuando interactúan con agua forman hidróxidos.
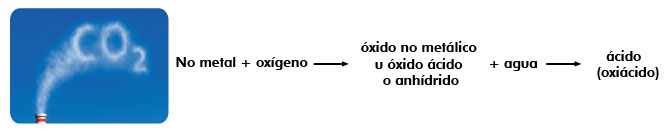
Los óxidos no metálicos en presencia de agua forman ácidos del tipo oxiácido.
REGLAS DE NOMENCLATURA
La nomenclatura química es un conjunto de reglas que se aplican para nombrar y representar con símbolos y fórmulas a los elementos y compuestos químicos. Actualmente se aceptan tres sistemas de nomenclatura donde se agrupan y nombran a los compuestos inorgánicos:
- Sistema de nomenclatura estequimétrico ó sistemático de la Unión Internacional de Química Pura y Aplicada, (IUPAC).
- Sistema de nomenclatura funcional, clásico ó tradicional.
- Sistema de nomenclatura Stock.
Para nombrar óxidos metálicos:
Resultan de la combinación del oxígeno con metales y al reaccionar con el agua producen bases.
Nomenclatura Stock
Se nombra con la palabra genérica óxido seguido de la preposición de enseguida el nombre del metal con el que se combinó, por ejemplo: óxido de calcio.
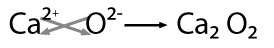
Nomenclatura clásica ó tradicional
Estos mismos compuestos se pueden nombrar con la palabra genérica óxido seguida del nombre del metal con el sufijo oso para el valor menor de la valencia y con el sufijo ico cuando el valor de su valencia es mayor, por ejemplo:

Nomenclatura IUPAC
La IUPAC determina que estos compuestos se nombran a partir de la cantidad de elementos que los constituyen, por ejemplo:
NiO se nombra Monóxido de níquel y el Ni2O3 Trióxido de diníquel
Para nombrar óxidos ácidos:
Son combinaciones del oxígeno con un no metal y al reaccionar con agua producen ácidos del tipo oxiácido.
Nomenclatura Stock
Nomenclatura clásica ó tradicional
Cuando el no metal presenta más de dos valencias como es el caso del cloro se conservan los sufijos de la regla anterior y se utilizan además: el prefijo hipo proveniente del griego "hypo" que significa inferior o debajo, y el prefijo hiper o per del griego "hyper" que significa mayor o superior, por ejemplo:
Nomenclatura IUPAC
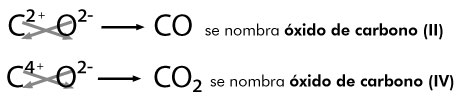
Dependiendo del número de valencias que presente el no metal, por ejemplo el carbono tiene dos valencias positivas 2+ y 4+, cuando actúa con el número de valencia 2+ al combinarse con el oxígeno 2-, se forma el monóxido de carbono, como se aprecia en la siguiente representación:
Cuando la combinación se lleva a cabo con la valencia 4+, resulta:
Para nombrar hidróxidos:
Nomenclatura Stock
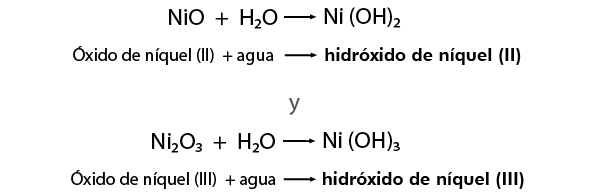
Nomenclatura clásica ó tradicional
Nomenclatura IUPAC
Para nombrar ácidos:
Nomenclatura Stock
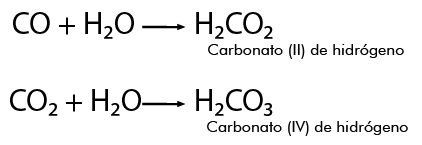
Nomenclatura clásica ó tradicional
Nomenclatura IUPAC
Para nombrar hidrácidos:
Nomenclatura Stock

Nomenclatura tradicional e IUAPAC
EJERCICIOS
EJERCICIO 1:
Co+O
Ca2O2 Óxido de Calcio (II)
Ca+O
Co2O3 Óxido
de Cobalto (III)
K+O K2O Óxido de Potasio
Al+O Al2O3 Óxido de Aluminio (III)
Cu+O
Cu2O Óxido de cobre (I)
Cu+O
Cu2O2 Óxido
de cobre (II)
EJERCICIO 2:
|
Hidróxido
(OH)-
|
Metal
|
Fórmula
|
Nombre
|
|
(OH)-
|
Li1+
|
LiOH
|
Hidróxido de litio
|
|
Ca2+
|
Ca(OH)2
|
Hidróxido de
calcio
|
|
Al3+
|
Al(OH3)
|
Hidróxido de aluminio
|
EJERCICIO 3:
|
N2O5
|
Anhídrido nítrico
|
Óxido de nitrógeno (V)
|
Pentaóxido de dinitrogeno
|
|
FeO
|
Oxido ferroso
|
Óxido de hierro (II)
|
Monóxido de fierro
|
|
HClO
|
Monoxoclorato de
hidrogeno
|
Clorato (I) de
hidrogeno
|
Acido hipocloroso
|
|
Al2O3
|
Oxido alumínico
|
Oxido de aluminio
|
Trióxido de dialuminio
|
|
Co2O3
|
Oxido cobaltico
|
Oxido de cobalto
(III)
|
Trióxido de
dicobalto
|
|
H2SO4
|
Acido sulfúrico
|
Sulfato (VI) de hidrogeno
|
Teraoxosulfato(VI) de hidrogeno
|
|
Na2O
|
Oxido sódico
|
Oxido de disodio
|
|
|
Ba(OH)2
|
Hidróxido barico
|
Hidróxido de
bario
|
Hidróxido de
bario
|
|
I2O5
|
Anhidrico yodico
|
Oxido de yodo (V)
|
Pentaoxido de diyodo
|
|
HBr
|
Acido bromhídrico
|
Bromuro de
hidrogeno
|
|
EJERCICIO 4:
a. CaCl2 + K2SO3 CaSO3 + 2KCl
CaSO3 + 2KCl
b. CaCl + K2SO3 CaSO3 + KCl
CaSO3 + KCl
_
Óxido de zinc + ácido fosfórico  fosfato de zinc + agua
fosfato de zinc + agua
a. 3ZnO + H3PO4 3 ZnPO4 + H2O
3 ZnPO4 + H2O
b. 3ZnO +
2H3PO4 Zn3(PO4)2 + 3H2O
Zn3(PO4)2 + 3H2O
_
2.- Escribe la letra de la fórmula correcta del producto que se forma en
cada reacción.
2ba + O2 à 2BaO
Br2O + H2O à 2HBrO
FeO + H2O à Fe(OH)2